Representa un papel esencial en la vida de los animales y de las plantas (respiración), así como en las actividades humanas (cocción de alimentos, lucha contra el frío, preparación de metales, etc.).
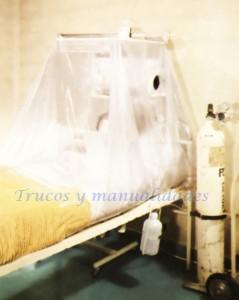
Una tienda de oxígeno. EL oxígeno es muy empleado en medicina (oxigenoterapia), particularmente para La respiración artificial y La reanimación cardíaca.
El aire vital
Sin el oxígeno no existiría prácticamente ningún género de vida. Por eso era antaño designado con el nombre de aire vital. Al inspirar hacemos penetrar oxígeno en nuestro organismo, por el cual circula gracias a los glóbulos rojos de la sangre. También toma parte en combinaciones químicas: con el carbono de los alimentos forma el gas carbónico que espiramos. Proporciona energía a nuestro cuerpo y asegura el mantenimiento de su temperatura. Estas funciones esenciales explican el hecho de que la falta de aire, o el aire desprovisto de oxígeno (lugar cerrado, lleno de humo), provoquen graves trastornos que pueden llegar hasta la asfixia.
El calor y la luz
Lavoisier fue el primero que estudió la combustión (conjunto de reacciones químicas que tienen lugar en presencia de oxígeno y que van acompañadas de desprendimiento de calor). Las materias llamadas combustibles están compuestas, en parte, de carbono (C). Al quemarse este carbono se combina con el oxígeno del aire para dar gas carbónico (C02) y óxido de carbono (CO), que se encuentran en el humo.
El fuego, una combustión viva, es una reacción química violenta, con desprendimiento de calor y de luz, pero a costa de un gran gasto de oxígeno. Así, un motor de automóvil precisa (en peso) 14 partes de aire por 1 de gasolina, lo que representa un volumen enorme (el aire sólo pesa 1,3 kilogramos por metro cúbico).
Soldadura con soplete oxiacetilénico (mezcla, bajo presión de acetileno y oxígeno Según la naturaleza de gas con que reacciona el oxígeno, se obtienen temperaturas más o menos elevadas: 1800º C con el gas de alumbrado, 2100º C con el hidrógeno y 2500º C con el acetileno.
Oxígeno natural y oxígeno industrial
La formación de óxidos resulta de unas reacciones más o menos vivas, más o menos lentas, donde el oxígeno se combina con cuerpos diversos. Los metales figuran entre las materias que se oxidan más fácilmente. El hierro por ejemplo se cubre de herrumbre en presencia de oxígeno.
A pesar del fuerte consumo, la cantidad de oxígeno presente en la atmósfera permanece prácticamente estable. Las plantas se encargan de compensar el que el mundo animal consume: absorben gas carbónico, retienen el carbono y expulsan el oxígeno. Por ello siempre resulta grave cortar árboles, que son los principales productores de oxígeno.
El oxígeno puro se fabrica industrialmente (por destilación del aire líquido) y se vende comprimido en botellas metálicas. Este oxígeno industrial permite una combustión mucho más viva: los sopletes de gas, de acetileno, de hidrógeno o de butano, que son alimentados con oxígeno a presión, pueden soldar y cortar los metales.
El oxígeno puro también es útil para los seres vivos: es posible salvar a ciertos enfermos si se les coloca bajo una tienda de oxígeno. También sirve para crear una atmósfera artificial (presurización) en los aviones, en los submarinos, etc. Pero hay que tener cuidado con su dosificación: un exceso de oxígeno provoca una especie de embriaguez, semejante a la que experimentan los alpinistas a grandes alturas.
Trabajar bajo tierra.
El clorato de potasa desprende oxígeno por efecto del calor. Por tanto, para hacer respirables las atmósferas cerradas, como las de los subterráneos, las de los submarinos o las de los aviones, se emplean composiciones a base de clorato.
Trastornos y asfixia.
Para respirar normalmente, el hombre debe vivir en una atmósfera que contenga un 20 % de oxígeno. Cuando esta proporción desciende, se producen una serie de trastornos. Se puede sobrevivir con aire que contenga un 14 % de oxígeno. Pero, a partir de 7 % se presentan trastornos graves que pueden producir la muerte por asfixia cuando el tenor de oxígeno desciende a 3%.
La entrada Sabías que el oxíeno es un gas incoloro e inodoro; densidad: 1,105 aparece primero en trucosymanualidades.com.